Depuis la EHA 2019
Dr Milena Kohn, hématologue au Centre Hospitalier de Versailles, Le Chesnay
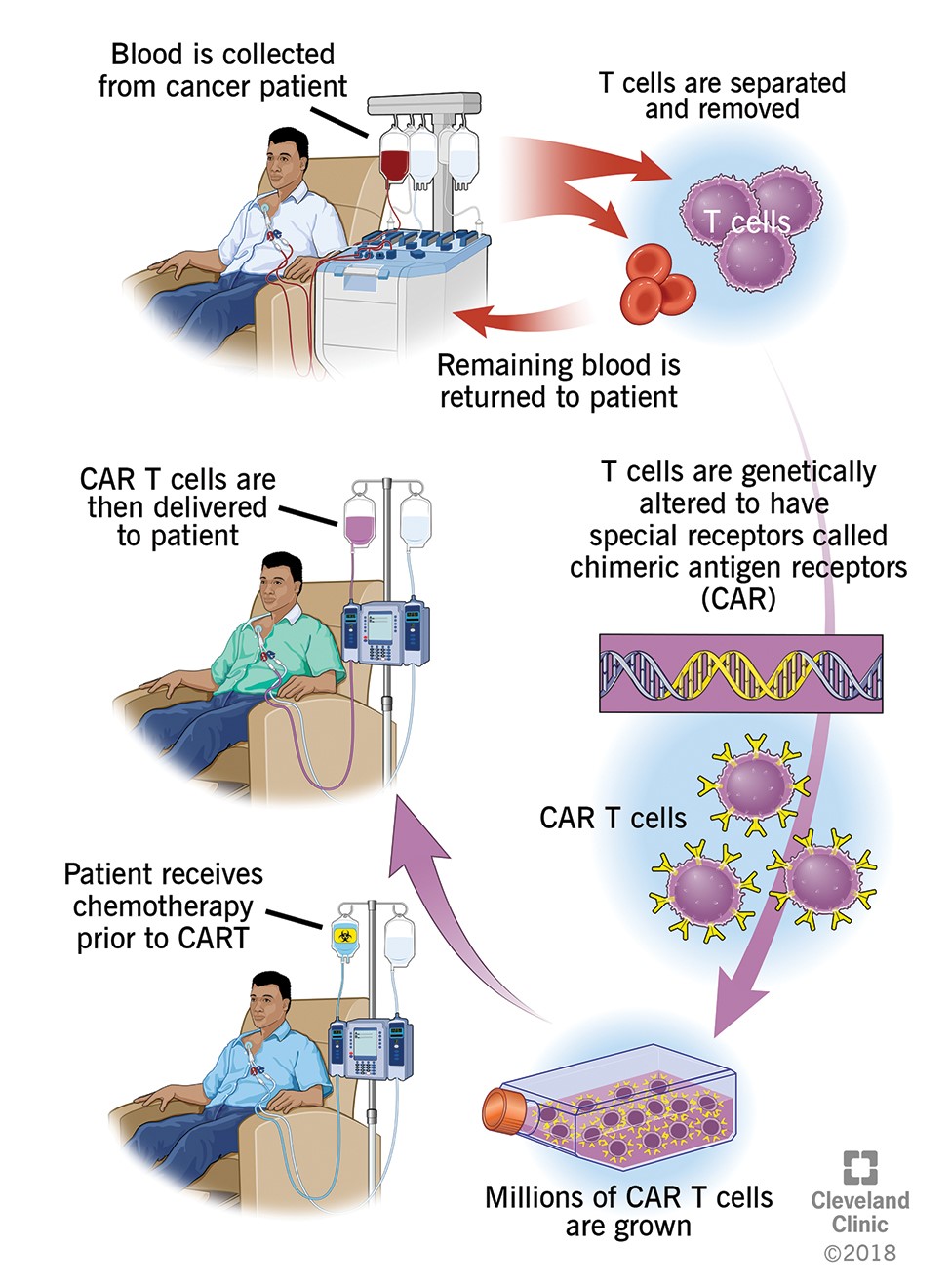
Les « CART cells » ou cellules T porteuses d’un récepteur chimérique représentent la dernière révolution de la thérapie génique dans le traitement des cancers ; comme pour l’immunothérapie en général, le principe de ce traitement est de se servir du système immunitaire du patient comme arme contre les cellules cancéreuses. Plus particulièrement dans le cas des CART cells, les lymphocytes T du patient sont prélevés (par leucaphérèse, comme pour un don du sang) et modifiés génétiquement au laboratoire afin qu’elles présentent à leur surface un récepteur spécifique des cellules tumorales afin de les reconnaitre et de les détruire lorsqu’elles sont réinjectées au patient (par perfusion intraveineuse, comme pour une transfusion).
Deux médicaments (Yescarta® et Kymriah®) ont obtenu en 2018 une autorisation de mise sur le marché en Europe pour le traitement des leucémies aigues lymphoblastiques B (LAL B) et des lymphomes B diffus à grandes cellules en rechute. Leur cible est le CD19, une molécule présente à la surface de la majorité des LAL B. Les essais cliniques de phase 1 et 2 ont montré chez les patients (enfants et adultes) atteints de LAL B en rechute ou réfractaires des taux de réponse importants, allant de 70 à 90%.
Afin de favoriser l’expansion des lymphocytes T modifiés chez le patient, une chimiothérapie courte (par fludarabine et cyclophosphamide) est administrée avant la réinjection. Les principaux effets indésirables observés après réinjection sont le syndrome de relargage cytokinique (fièvre, baisse de la tension artérielle, troubles respiratoires) et des effets neurologiques (difficultés pour écrire ou parler, troubles de la mémoire, tremblements…) qui peuvent être sévères et nécessiter transitoirement une surveillance en réanimation pour recevoir des traitements spécifiques. Compte-tenu de ces spécificités, seuls certains centres sont qualifiés pour administrer les CART cells.
EHA 2019 : De nombreuses études sont en cours dans le but d’optimiser l’efficacité de ces CART cells tout en contrôlant mieux leurs effets indésirables, de comprendre les mécanismes de résistance et de tester d’autres cibles pour d’autres cancers hématologiques.
Leucémies aigues lymphoblastiques B (LAL B): thérapies ciblées
L’arsenal thérapeutique s’est récemment agrandi dans la prise en charge des LAL-B avec l’autorisation de mise sur le marché de plusieurs nouveaux médicaments ciblés: le blinatumomab, l’inotuzumab et les CART cells anti CD19 (cf rubrique dédiée).
Le blinatumomab (Blincyto®) est un anticorps bispécifique qui permet de rapprocher les lymphocytes T du patient des cellules leucémiques en se liant à la fois au CD3 (marqueur de surface des lymphocytes T) et au CD19 (marqueur de surface des lymphocytes B, présent également sur les cellules leucémiques de la LAL B). Les lymphocytes T du patient vont alors être activés et déclencher la mort des cellules leucémiques. Le blinatumomab s’administre par perfusion intraveineuse continue. Les résultats de l’essai TOWER puis de l’essai BLAST (dont les résultats finaux ont été présentés à l’EHA 2019) ont permis son autorisation de mise sur le marché pour les patients atteints de LAL B qui ne sont pas en rémission moléculaire complète à l’issue de la chimiothérapie classique d’induction. Les effets indésirables principaux sont le syndrome de relargage cytokinique (fièvre, baisse de la tension artérielle, troubles respiratoires) et des troubles neurologiques qui doivent parfois faire interrompre le traitement.
EHA 2019 : Des essais de stratégie « sans chimiothérapie » associant blinatumomab et inhibiteurs de tyrosine kinase sont en cours pour le traitement des LAL B avec chromosome Philadelphie (les premiers résultats de l’étude italienne GIMEMA LAL2116 D-ALBA ont été présentés à l’EHA 2019 et semblent prometteurs).
L’inotuzumab ozogamicine (Besponsa®) est un anticorps anti CD22 couplé à une molécule cytotoxique, l’ozogamycine (sur le même modèle que le gemtuzumab ozogamycine ou Mylotarg® développé dans la leucémie aigue myéloblastique). La molécule de surface CD22 est exprimée par la majorité des LAL B : une fois que l’anticorps anti CD22 se fixe à la surface de la cellule leucémique, l’ozogamycine est libérée à l’intérieur de la cellule et entraine sa mort. L’essai INO-VATE a montré chez des patients en rechute l’intérêt de l’inotuzumab en comparaison à la chimiothérapie standard en termes de réponse et de survie. Ce traitement s’administre par perfusion intraveineuse. Son principal effet indésirable est la survenue chez certains patients de complications hépatiques (maladie veino-occlusive).
Par ailleurs, la caractérisation biologique des leucémies aigues lymphoblastiques B et T devenant de plus en plus précise, le développement d’essais cliniques proposant des thérapies ciblées en association à la chimiothérapie ou dans des approches selon la présence d’anomalies moléculaires/chromosomiques est en cours (par exemple : inhibiteurs de tyrosine kinase et inihibiteurs de JAK dans les leucémies « Ph-like »).





