Les nouveaux traitements et les axes de recherche
A retenir
Les thérapies ciblées sont des médicaments dont l’action est dirigée plus spécifiquement sur les cellules tumorales que les chimiothérapies conventionnelles cytotoxiquesLes thérapies ciblées agissent de façon très différente comme par exemple :
- sur des voies de signalisation comme les inhibiteurs de tyrosine kinase, la première thérapie ciblée conçue comme telle dans la leucémie myéloïde chronique. L’imatinib en est le chef de file avec maintenant des inhibiteurs disponibles pour cibler de nombreuses tyrosines kinases dans les leucémies et les lymphomes
- sur des antigènes de surfaces comme les anticorps monoclonaux dans les lymphomes ou les leucémies aigues lymphoblastiques. Le rituximab a été un des premiers anticorps monoclonaux utilisé dans les lymphomes non hodgkinien en combinaison avec la chimiothérapie conventionnelle
- sur l’oncogène lui-même en induisant sa dégradation comme l’acide rétinoïque ou l’arsenic dans la leucémie à promyélocytes. D’autres thérapies ciblées modifient également la dégradation de protéines des cellules tumorales comme les inhibiteurs du protéasome utilisés dans le myélome multiple.
Certaines thérapies sont classées comme ciblées même si leur mécanisme d’action préférentiel sur les cellules tumorales reste incertain. C’est le cas par exemple des IMIDS (thalidomide, lenalidomide, pomalidomide) dans le myélome multiple qui ont une action dirigées contre l’angiogénèse mais qui stimulent aussi le système immunitaire.
Plus récemment, de nouvelles stratégies ciblant non plus la cellule tumorale mais le système immunitaire du patient en restaurant sa capacité à reconnaître les cellules tumorales ont été développées. C’est le cas des anticorps dirigés contre les molécules de blocage comme l’antigène PD1 par exemple.
Enfin, certaines molécules modifient l’expression des gènes en agissant sur les mécanismes de leur expression appelés aussi mécanismes épigénétiques. Ces agents agissent sur la méthylation des histones ou encore sur leur acétylation. Dans le domaine des leucémies ou des myélodysplasies, les traitements épigénétiques comme l’asacytidine permettent d’augmenter la survie des patients.
La compréhension et le traitement des hémopathies cancéreuses vont fortement évoluer ces prochaines années grâce au progrès dans la connaissance du génome tumoral grâce au séquençage à haut débit. Très prochainement, l’analyse complète du génome tumoral exprimé devrait être possible en moins de 48h donnant ainsi une vision globale de l’ensemble des altérations génétiques de la tumeur d’un patient en particulier, ouvrant la voie à un traitement personnalisé.
Les inhibiteurs de tyrosine kinase (ITK)
Ce sont de petites molécules qui vont entrer en compétition avec l’ATP qui représente la source d’énergie d’enzymes appelées tyrosines kinases. Le premier inhibiteur de tyrosine kinase à avoir été utilisé en thérapeutique est l’imatinib (Glivec ®). Ce traitement cible la tyrosine kinase BCR-ABL qui est une protéine de fusion résultant de la mise en continuité du gène BCR et de la kinase Abelson et qui est responsable de la Leucémie Myéloïde Chronique. L’évènement génétique qui conduit à cette fusion est une translocation entre les chromosomes 9 et 22 aussi appelée translocation t(9 ;22). Le petit chromosome 22 qui en résulte est aussi appelé chromosome de Philadelphie du nom de la ville où il a été découvert aux Etats-Unis dans les années 1960. L’imatinib va bloquer l’action de l’activité non régulé de BCR-ABL et ainsi progressivement entrainer l’élimination des cellules porteuses du chromosome de Philadelphie. Le traitement par imatinib a révolutionné le pronostic de la Leucémie Myéloïde Chronique. Des inhibiteurs de seconde et de troisième génération ont par la suite été développé afin de traités les patients résistants à l’imatinib ou intolérants. Une partie des patients résistants développent des mutations du domaine kinase de BCR-ABL. Une mutation en particulier, la mutation T315I n’est sensible qu’au ponatinib. D’autres ITKs sont maintenant développés dans les leucémies associées à la mutation FLT3 par exemple et contre les mutations IDH1 et IDH2.
|
Nom |
DC1 |
Laboratoire |
Pathologie |
Cible |
|
Glivec® |
imatinib |
Novartis |
LMC et LAL chr Ph+ |
bcr-abl, PDGFR |
|
Sprycel |
dasatinib |
BMS |
LMC et LAL chr Ph+ |
bcr-abl, PDGFR |
|
Tasigna |
nilotinib |
Novartis |
LMC |
bcr-abl |
|
Bosulif |
bosutinib |
Pfizer |
LMC |
bcr-abl |
|
Iclusig |
ponatinib |
Ariad |
LMC |
Bcr-abl |
Les anticorps monoclonaux (17 / 18)
Les anticorps monoclonaux ont été parmi les premières thérapeutiques ciblées. Leur chef de file en hématologie reste le rituximab, qui cible l’antigène de surface CD20 exprimé sur la plupart des hémopathies issues de la lignée des lymphocytes B. Le rituximab est surtout utilisé en association avec la chimiothérapie conventionnelle dans les lymphomes non hodgkiniens.
D’autres antigènes peuvent être ciblés par les anticorps monoclonaux comme l’antigène CD33 exprimé à la surface des cellules de leucémie aigue myéloblastique, l’antigène CD30 exprimé sur certaines cellules de lymphomes.
Les anticorps monoclonaux ont été couplés à des molécules de chimiothérapie, des toxines, des agents radioactifs. Les anticorps servent alors de vecteurs pour apporter au plus près des cellules tumorales un agent cytotoxique.
Les principaux produits utilisés sont les suivants :
|
Marque |
DCI |
Fabricant |
Pathologie(s) concernée(s) |
Cibles |
|
Mabthera® |
rituximab |
Roche |
lymphome non hodgkinien (LNH) |
antigène CD20 |
|
Mabcampath® |
alemtuzumab |
Bayer |
leucémie Lymphoïde Chronique |
antigène CD52 |
|
Zevalin® |
ibritumomab tiuxetanY90 |
Schering |
lymphome non hodgkinien (LNH) |
antigène CD20 + ytrium90 |
|
Mylotarg® |
gemtuzumab ozogamycine |
Pfizer |
leucémie aigue myéloïde |
antigène CD33 calicheamycine |
|
Adcetris® |
brentuximab vedotin |
Takeda |
lymphome anaplasique lymphome hodgkinien |
antigène CD30 MMAE |
|
Phase 3 |
inotuzumab |
Pfizer |
leucémies Aigues lymphoblastiques |
antigène CD22 calicheamycine |
|
Phase 3 |
epratuzumab |
UCB |
lymphomes |
antigène CD22 |
|
Phase 3 |
daratumomab |
Janssen |
myélomes |
antigène CD38 |
Les nouveaux anticorps monoclonaux sont des molécules remaniées et construites par génie génétique. Le plus emblématique de ces nouveaux anticorps est le blinatumomab, qui est une molécule chimérique qui allie un site de reconnaissance de l’antigène CD20 sur la cellule tumorale et un site de fixation et d’activation du CD3 sur les lymphocytes cytotoxiques du patient lui-même. Ainsi, le blinatumomab permet un contact direct entre la cellule tumorale et les lymphocytes T cytotoxiques.
Dégradation protéique et inhibiteurs du protéasome
Historiquement, la première molécule ciblée à avoir été utilisée en hématologie est l’acide tout-trans rétinoïque (Vesanoïde) dans le traitement de la leucémie aiguë à promyélocytes. Initialement interprété comme un traitement induisant la différenciation des cellules leucémiques, on sait maintenant que le Vésanoïde entraine également la dégradation de la protéine de fusion PML-RARA qui caractérise la leucémie à promyélocytes. Cette dégradation est également induite par le traitement par l’arsenic trioxyde (Trisenox®). La combinaison de l’acide tout-transrétinoïque et de l’arsenic trioxyde est capable d’entrainer la guérison des patients atteints de leucémie aigue à promyélocytes
|
Marque |
DCI |
Fabricant |
Pathologie(s) concernée(s) |
Cibles |
|
Vesanoide |
trétinoine |
Roche |
leucémie aigue promyélocytaire |
RARA |
|
Trisenox |
arsenic trioxide |
Teva |
leucémie aigue promyélocytaire |
RARA |
Les inhibiteurs du protéasome cible un organelle indispensable à la cellule, le protéasome chargé de la dégradation et du recyclage des protéines. C’est aussi un régulateur très fin de la durée de vie de certaines protéines clefs du cycle cellulaire et de la prolifération. Les inhibiteurs du protéasome ont été développés dans le myélome multiple où ils constituent le socle de la plupart des protocoles modernes de traitement du myélome. Ils sont associés à la dexaméthasone (un corticoïde) et aux IMiD (voir infra). Le chef de file de cette classe thérapeutique est le bortezomib (Velcade®). Les nouveaux inhibiteurs du protéasome sont en cours de développement comme la carlfilzomib ou l’ixazomib.
|
Marque |
DCI |
Fabricant |
Pathologie(s) concernée(s) |
Cibles |
|
Velcade |
bortezomib |
Millenium |
myélome |
protéasome |
Les IMiD (immunomodulatory drugs)(19)
Les IMID constituent une nouvelle classe thérapeutique, dont les principaux composés sont la thalidomide, le lénalidomide et le pomatinib. Leur mode d’action est basé sur leurs propriétés immunomodulatrices et antiangiogéniques, mais également sur un effet direct antitumoral. Le thalidomide et le lénalidomide ont reçu une AMM pour le traitement du myélome multiple. Les syndromes myélodysplasiques 5q- sont également une indication validée du lénalidomide. De nombreuses autres hémopathies malignes pourraient bénéficier de ces deux molécules, ou d’un troisième dérivé, le pomalidomide. Les IMiD constituent des substances majeures dans l’arsenal thérapeutique en hématologie à l’heure actuelle. Ils ont l’avantage d’être donnés par voie orale, et leur bonne tolérance permet l’utilisation de ces molécules pour des patients âgés. Les associations optimales avec des chimiothérapies ou d’autres thérapeutiques ciblées doivent encore être définies dans de nombreuses indications.
Les progrès de la génomique
Les connaissances produites grâce à la génomique ont un impact important sur le diagnostic, la prévention et le traitement des maladies. Ainsi l'étude des altérations génétiques des cellules tumorales doit permettre le développement de nouveaux outils diagnostiques et l'identification de meilleures stratégies thérapeutiques en déterminant les marqueurs prédictifs de la réponse à une thérapie afin de ne traiter que les patients répondeurs.
La génomique des cancers fait l'objet de grands programmes de coopération nationale et internationale. C’est ainsi que l'Institut National du Cancer représente la France au sein de l'International Cancer Genome Consortium (ICGC), dont l'objectif est de dresser un catalogue des mutations somatiques des cancers les plus fréquents et les plus graves.
Cette voie de recherche permet d’espérer la mise au point dans le futur de traitements adaptés à chaque forme de leucémies dont on sait aujourd’hui qu’elles sont pour la plupart liées à des anomalies génétiques. Les nombreuses mutations génétiques découvertes dans les LAM montrent l’ampleur du champ de recherche à explorer (24)
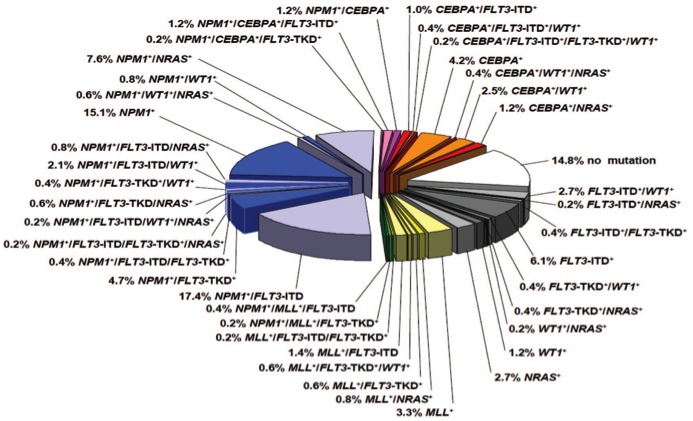
Mutations génétiques dans les LAM(27)





